Rượu công thức hóa học là gì? Đặc điểm và ứng dụng của rượu
Rượu công thức hóa học là một chủ đề thú vị với nhiều khía cạnh liên quan đến khoa học và đời sống hàng ngày. Rượu không chỉ được biết đến như một loại đồ uống phổ biến mà còn là một hợp chất hóa học quan trọng trong nhiều ngành công nghiệp. Trong bài viết này, Ánh Vang sẽ cùng bạn tìm hiểu chi tiết về rượu, công thức hóa học của nó, và các ứng dụng đa dạng trong cuộc sống.
1. Rượu công thức hóa học là gì?
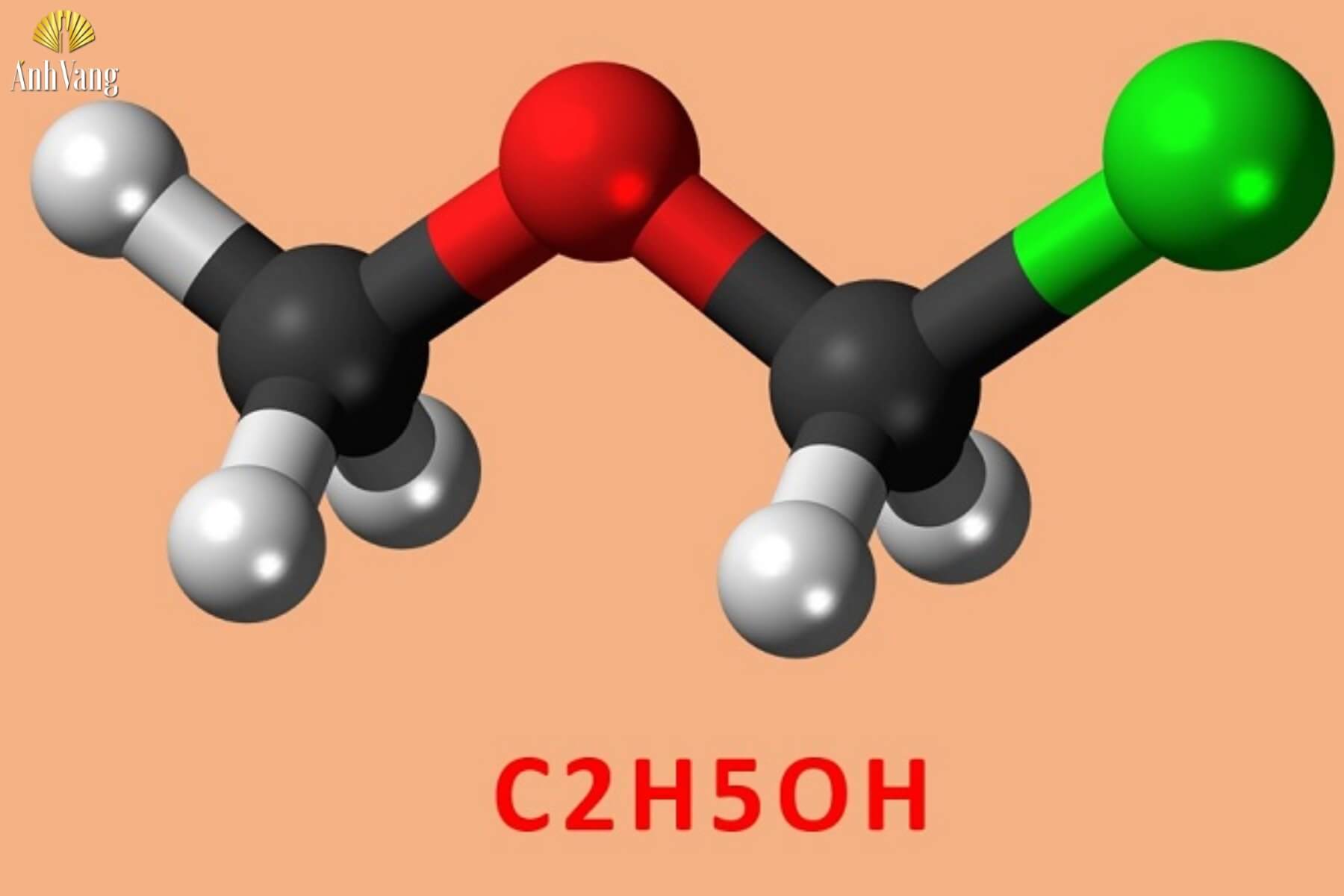
Rượu, còn gọi là ethanol hay ethyl alcohol, là một hợp chất hữu cơ chứa nhóm hydroxyl (-OH) liên kết với một nguyên tử carbon. Ethanol có công thức hóa học là C₂H₅OH. Ethanol là thành phần chính trong các loại đồ uống có cồn và được sử dụng rộng rãi trong các lĩnh vực như công nghiệp, y tế, và mỹ phẩm.
Trong rượu vang, thành phần chính là ethanol, được tạo ra từ quá trình lên men đường glucose có trong nho. Ngoài ethanol, rượu vang còn chứa nhiều hợp chất hóa học khác như axit hữu cơ, tannin, chất tạo mùi, và các loại đường. Các hợp chất này đóng vai trò quan trọng trong việc hình thành hương vị, cấu trúc, và đặc trưng của rượu vang. Tannin (C₇₆H₅₂O₄₆), có trong vỏ, hạt và cuống nho, mang đến vị chát và cảm giác khô miệng, đồng thời bảo vệ và ổn định rượu vang trong quá trình lão hóa.
Các chất tạo mùi trong rượu vang bao gồm aldehyde, keton, ester, phenol, và hợp chất sulfur. Aldehyde và keton là các hợp chất chứa nhóm carbonyl (C=O), góp phần tạo ra mùi hương đặc trưng của rượu vang. Ester, với công thức chung R-COO-R’, tạo nên các hương thơm khác nhau. Phenol có nhóm hydroxyl (-OH) gắn vào một nhóm aryl, tạo nên mùi hương độc đáo và mang đến tính chất đặc biệt cho rượu vang. Các hợp chất sulfur như sulfhidril và các hợp chất sulfur hữu cơ khác, góp phần tạo ra mùi hương phức tạp và độ sâu của rượu vang.
2. Tính chất hóa học của rượu
Ethanol là một hợp chất hóa học rất hoạt động, với khả năng tạo liên kết hydro đặc trưng, góp phần vào tính dễ cháy của nó. Khi ethanol cháy trong không khí, nó tạo ra ngọn lửa xanh và tỏa ra nhiều nhiệt. Nhóm hydroxyl (-OH) trong cấu trúc của ethanol cũng tham gia vào nhiều phản ứng hóa học quan trọng, bao gồm phản ứng oxy hóa, phản ứng este hóa và phản ứng với kim loại kiềm.
Dưới đây là các phản ứng hóa học đặc trưng của ethanol:
- Phản ứng với kim loại kiềm: Ethanol phản ứng với các kim loại kiềm như Kali (K), Natri (Na) và Bari (Ba), giải phóng khí Hydro (H₂). Phản ứng này đặc trưng bởi sự hình thành muối và khí Hydro. Phương trình phản ứng là:
2C2H5OH+2Na→2C2H5ONa+H2
- Phản ứng với axit axetic: Khi ethanol phản ứng với axit axetic (CH₃COOH) trong sự hiện diện của axit sulfuric đặc (H₂SO₄), xảy ra phản ứng este hóa, tạo thành este và nước. Đây là một phản ứng quan trọng trong công nghiệp sản xuất este. Phương trình phản ứng là:
C2H5OH+CH3COOH⇌ CH3COOC2H5+H2O
- Phản ứng oxy hóa: Ethanol cháy dễ dàng trong không khí, tạo ra ngọn lửa màu xanh da trời và không sinh khói. Trong quá trình cháy, ethanol tạo ra khí Carbon Dioxide (CO₂) và nước (H₂O), đồng thời tỏa ra một lượng nhiệt đáng kể. Phương trình phản ứng oxy hóa của ethanol là:
C2H5OH+3O2→2CO2+3H2O

3. Tính chất vật lý của rượu
Ở điều kiện thường, rượu là chất lỏng không màu, trong suốt, có mùi thơm đặc trưng và vị cay. Nhờ liên kết hydro, rượu có nhiệt độ sôi cao hơn đáng kể so với các hợp chất hữu cơ có khối lượng phân tử tương đương, khoảng 78,37°C. Điều này đồng nghĩa với việc rượu dễ bay hơi ở nhiệt độ phòng.
Bên cạnh đó, rượu còn có khả năng hòa tan tốt trong nước và nhiều dung môi hữu cơ khác như benzen, iod. Tính chất phân cực của nhóm hydroxyl (-OH) là yếu tố chính quyết định khả năng hòa tan này.
4. Rượu làm từ gì? Phương pháp sản xuất rượu
Rượu và cồn, đặc biệt là Ethanol, có thể được sản xuất từ nhiều phương pháp khác nhau. Trong ngành công nghiệp sản xuất đồ uống có cồn, hai phương pháp chính được sử dụng là lên men và tổng hợp hóa học.
4.1. Phương pháp Lên men
Ethanol thường được sản xuất thông qua quá trình lên men từ các nguyên liệu chứa tinh bột hoặc đường, chẳng hạn như hạt ngũ cốc và trái cây. Trong quá trình lên men, men rượu chuyển hóa đường trong điều kiện không có oxy để tạo ra Ethanol và Cacbon Dioxit (CO2). Phương trình hóa học cho quá trình này là:
C6H12O6→ 2 CH3CH2OH+ 2 CO2
Để sản xuất rượu, quá trình này cần được thực hiện trong các điều kiện cụ thể để men rượu có thể phát triển và tạo ra Ethanol. Để tăng nồng độ Ethanol, các sản phẩm rượu thường được chưng cất. Ví dụ, trong sản xuất rượu vang hoặc Whisky, tinh bột trong ngũ cốc hoặc trái cây phải được chuyển hóa thành đường trước khi lên men. Điều này được thực hiện bằng cách ủ mạch nha để sản sinh các enzym có khả năng phá vỡ tinh bột.
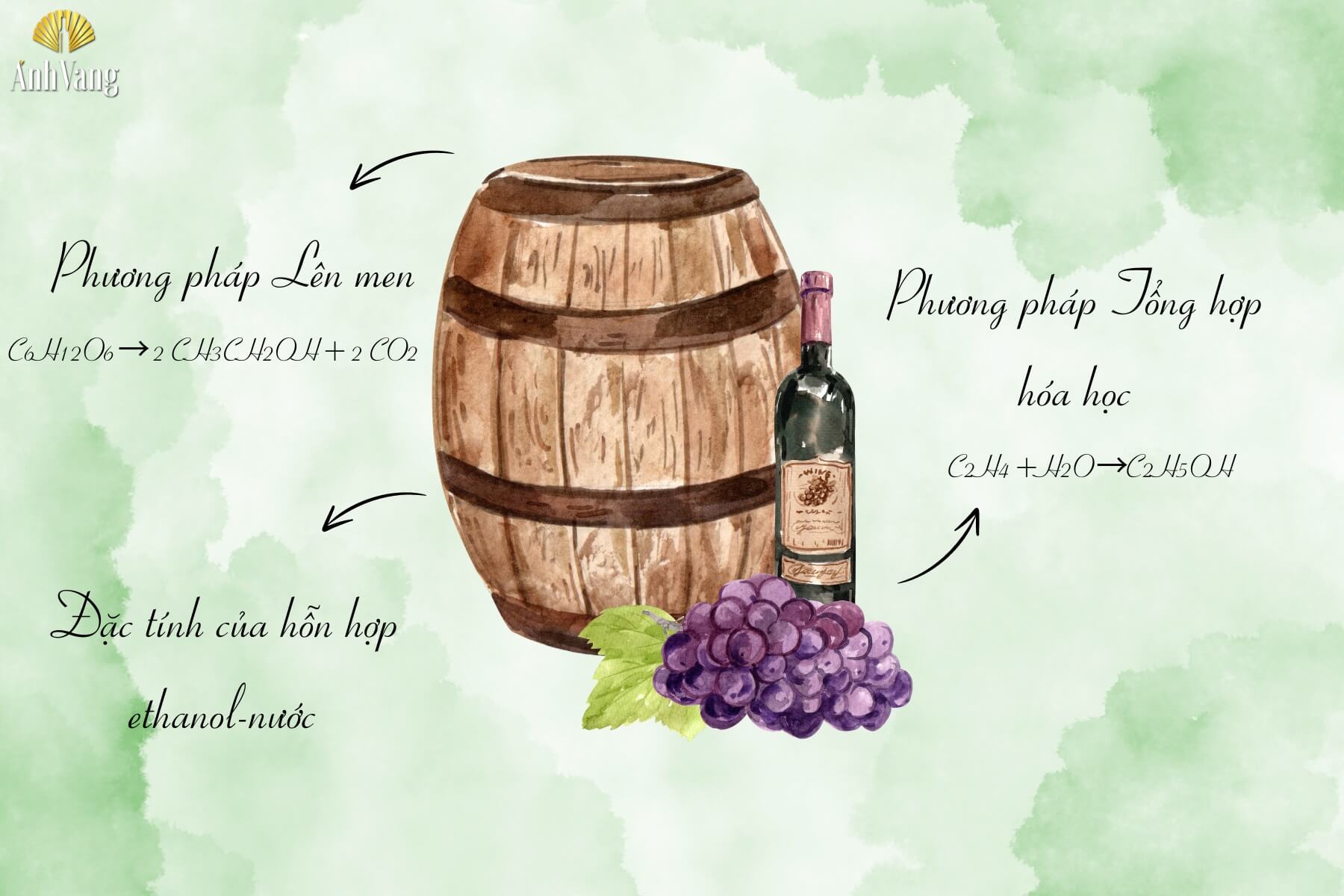
4.2. Phương pháp Tổng hợp hóa học
Ngoài phương pháp lên men, Ethanol cũng có thể được điều chế qua các phản ứng hóa học. Một trong những phương pháp công nghiệp phổ biến là hydrat hóa ethylene. Quá trình này diễn ra trong điều kiện nhiệt độ và áp suất cao với sự có mặt của chất xúc tác axit, thường là Acid Phosphoric hoặc Axit Sulfuric. Phản ứng chính trong quá trình này là:
C2H4+H2O→C2H5OH
Trong quá trình sản xuất công nghiệp, ethylene sẽ phản ứng với Axit Sulfuric đậm đặc để tạo ra Ethyl Sulfat, sau đó Ethyl Sulfat sẽ được thủy phân để tạo ra Ethanol và tái tạo lại Axit Sulfuric. Tuy nhiên, phương pháp này hiện đã ít được sử dụng và gần như đã bị thay thế bởi các công nghệ khác.
4.3. Đặc tính của hỗn hợp ethanol-nước
Khi chưng cất hỗn hợp Ethanol và nước, điểm sôi cực đại của hỗn hợp là 96% Ethanol và 4% nước. Điều này có nghĩa là không thể chưng cất phân đoạn hỗn hợp này để tạo ra Ethanol tinh khiết hơn 96%. Do đó, dung dịch chứa 95% Ethanol trong nước thường được sử dụng làm dung môi phổ biến nhất trong công nghiệp.
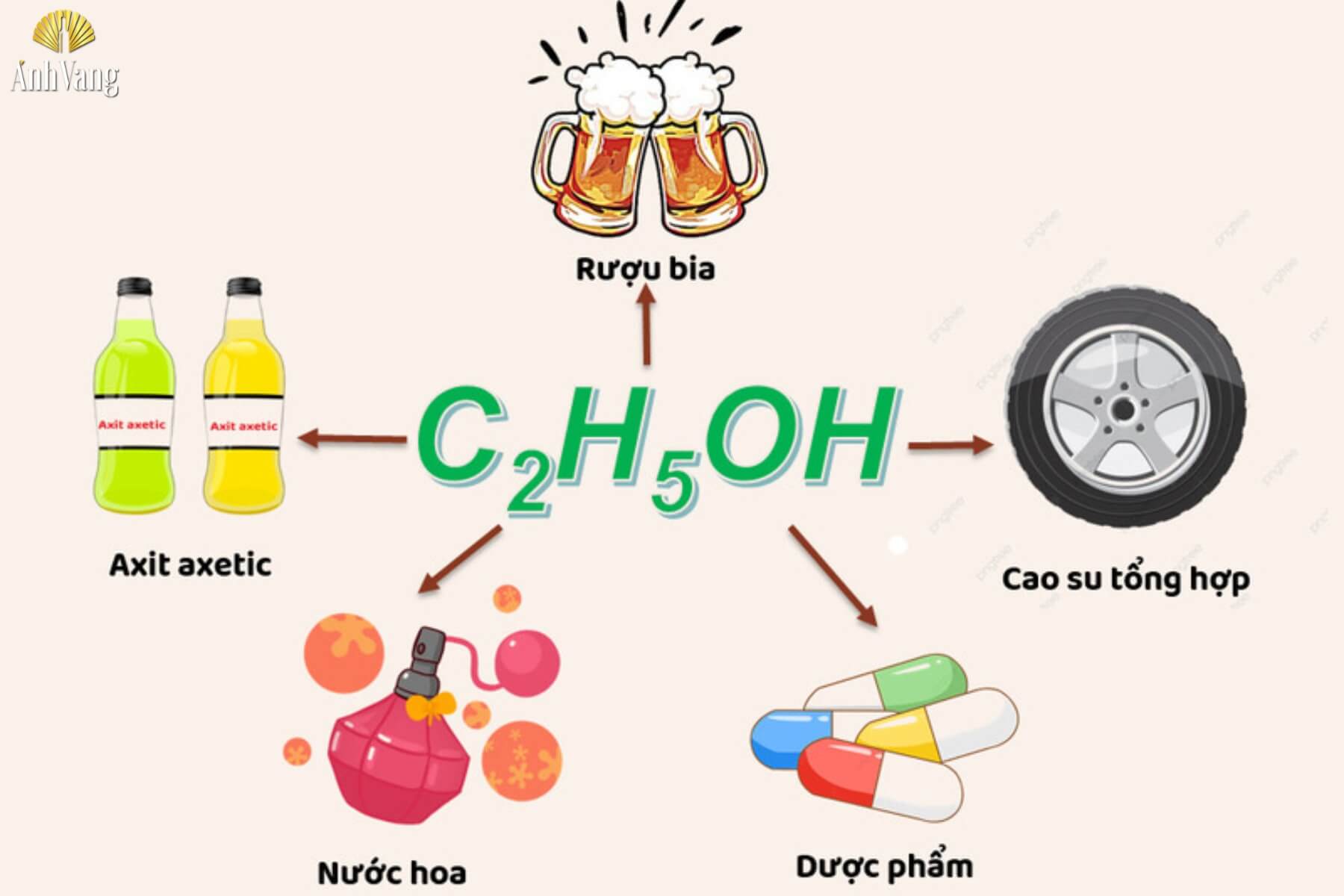
4.4. Ứng dụng của rượu trong đời sống
Rượu, với các loại như ethanol, methanol, và butanol, đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau nhờ vào các đặc tính và ứng dụng đa dạng của chúng.
- Trong ngành y tế và chăm sóc sức khỏe
Ethanol và isopropanol là hai loại rượu được sử dụng rộng rãi trong y tế như chất sát trùng và khử trùng. Ethanol với nồng độ từ 70% đến 90% thường được dùng để diệt khuẩn hiệu quả, giúp làm sạch vết thương và dụng cụ y tế. Nó cũng được sử dụng trong sản xuất các loại gel vệ sinh kháng khuẩn. Isopropanol, với các tính chất tương tự, cũng được áp dụng trong nhiều sản phẩm y tế để sát trùng và khử trùng.
- Trong ngành thực phẩm và đồ uống
Ethanol là thành phần chính trong các loại đồ uống có cồn như bia, rượu vang, và rượu mạnh. Bên cạnh đó, nó còn được sử dụng trong công nghiệp thực phẩm như một chất bảo quản và phụ gia hương liệu. Ethanol giúp bảo quản thực phẩm lâu hơn và cải thiện hương vị của sản phẩm.
- Trong công nghiệp
Trong ngành công nghiệp, methanol và butanol được dùng làm dung môi trong sản xuất nhựa, sơn, và các sản phẩm tiêu dùng khác. Ethanol và methanol cũng là nguồn nhiên liệu tái tạo, góp phần giảm phát thải khí nhà kính. Rượu cũng đóng vai trò quan trọng trong việc sản xuất các hóa chất như formaldehyde, axit axetic, và andehit fomic. Ethanol còn được sử dụng trong sản xuất ethanol nhiên liệu sinh học và trong ngành công nghiệp chất dẻo để chế tác các sản phẩm chống đông lạnh.
- Trong ngành giao thông và năng lượng
Rượu, đặc biệt là ethanol, còn được sử dụng làm nhiên liệu cho ngành giao thông vận tải và trong các đèn cồn phòng thí nghiệm. Nó cũng góp phần vào việc tăng tỉ lệ octan trong quá trình sản xuất methyl tert-butyl ether (MTBE), một chất phụ gia trộn vào xăng để cải thiện hiệu suất động cơ.
5. Lời kết
Hy vọng bài viết này đã cung cấp cho bạn một cái nhìn toàn diện về rượu từ góc độ hóa học. “Rượu công thức hóa học” không chỉ đơn thuần là các loại đồ uống mà còn có những ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau. Hiểu rõ về công thức hóa học của rượu sẽ giúp bạn sử dụng chúng an toàn và hiệu quả hơn trong cuộc sống hàng ngày.
Đừng quên ghé thăm website Ánh Vang để xem thêm bộ sưu tập rượu vang nhập khẩu chính hãng từ những nhà sản xuất hàng đầu thế giới tại Ý, Pháp, Chile, New Zealand, Tây Ban Nha.
Quý khách có thể liên hệ Hotline/Zalo số điện thoại: 096 3030 356 hoặc liên hệ Facebook Rượu Ánh Vang để được tư vấn và đặt hàng nhanh nhất.
 Miễn phí giao hàng tiêu chuẩn cho các đơn hàng trên 600.000đ
Miễn phí giao hàng tiêu chuẩn cho các đơn hàng trên 600.000đ



